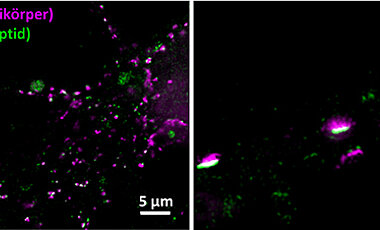
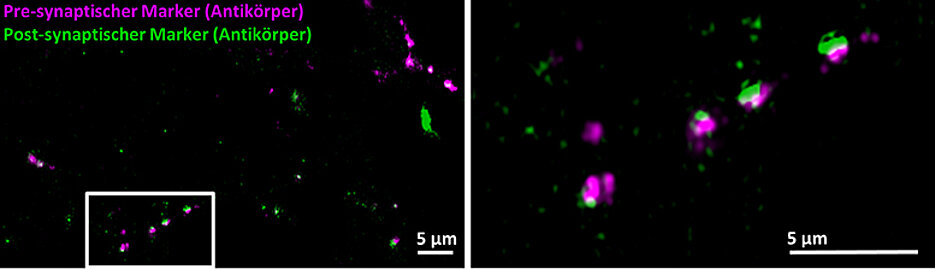
Peptide als Marker in der Fluoreszenz-Mikroskopie
Fortschritt in der biomedizinischen Bildgebung: Das Biozentrum der Uni Würzburg hat in enger Kooperation mit der Uni Kopenhagen einen alternativen Ansatz zur Fluoreszenzmarkierung von Proteinen entwickelt. Die neuen Sonden sind praktikabel und kompatibel mit hochauflösenden Mikroskopie-Verfahren.
Die Fluoreszenzmikroskopie macht die molekularen Bausteine von Zellen sichtbar. Proteine von Nervenzellen zum Beispiel lassen sich mit Sonden markieren, die dann mit Licht angeregt werden und daraufhin fluoreszieren. Am Ende wird das Fluoreszenz-Signal genutzt, um mikroskopische Abbilder der realen Position, Anordnung und Anzahl der Proteine zu erzeugen.
„Eine große Schwierigkeit dabei ist es, das jeweils interessierende Protein effektiv und hoch spezifisch zu markieren“, sagt Professor Markus Sauer vom Lehrstuhl für Biotechnologie und Biophysik der Universität Würzburg. Für diesen Zweck würden oft Antikörper eingesetzt, weil sie fest und selektiv an Proteine binden. „Allerdings ergeben sich daraus relativ unscharfe Bilder, weil die Antikörper selbst große Proteine sind.“
Bisherige Ansätze kaum praktikabel
Die Nachteile von Antikörpern zeigen sich unter anderem in der neurobiologischen Forschung – etwa wenn es darum geht, auf molekularer Ebene die Funktionsweise des Gehirns und der Nervenzellen zu verstehen.
Hier gab es mehrere Versuche, das Synapsen-Gerüstprotein Gephyrin mit verbesserten Markern sichtbar zu machen. „Doch die Ansätze waren bis jetzt wenig praktikabel, weil sie entweder eine genetische Manipulation der Zellen voraussetzten oder eben auf Antikörpern basierten, die wiederum durch ihre erhebliche Größe die Auflösung der Bilder einschränkten“, erklärt Sauer.
Alternative Strategie verwirklicht
Um auf diesem Feld Fortschritte zu erzielen, hat Sauers Forschungsgruppe in Kooperation mit der Universität Kopenhagen eine alternative Strategie verfolgt: die Entwicklung von Peptid-Sonden. Diese sollten wesentlich kleiner als Antikörper sein, aber trotzdem mit vergleichbarer Effektivität an ihre Zielproteine binden. Die Ergebnisse sind im Fachmagazin „Nature Chemical Biology“ veröffentlicht.
„Hier in Kopenhagen haben wir eine Technologie-Plattform aufgebaut, die es uns ermöglicht, eine Vielzahl modifizierter Peptide im Mikrochip-Format gleichzeitig darzustellen und zu testen. Damit war es uns ein Leichtes, ein spezifisches Peptid für Gephyrin zu entwickeln“, sagt Professor Hans Maric vom Zentrum für Biopharmazeutika. Damit das Peptid auch als Sonde taugt, wurde es mit zwei weiteren Funktionalitäten versehen: Eine macht es membrangängiger, die andere verleiht ihm Fluoreszenz.
Was mit dem neuen Ansatz möglich ist
Bisher hat die Forschungsgruppe an der Uni Würzburg die neuen Sonden vor allem benutzt, um die Praktikabilität des Ansatzes zu prüfen. Mit den Ergebnissen ist das Team zufrieden: „Es erscheint uns jetzt möglich, ähnliche Sonden für andere Schlüsselproteine zu entwickeln“, so Sauer.
Der Würzburger Professor beschreibt die Möglichkeiten, die sich durch die neue Entwicklung ergeben: „Hoch spezifische, effektiv bindende und vor allem kleine Sonden haben ein großes Potential. Sie können helfen, die Anordnung der Proteine in ihrem natürlichen zellulären Zusammenhang aufzuklären und sogar ihre Quantifizierung zu ermöglichen.“
Maric, H. M., Hausrat, T. J., Neubert, F., Dalby, N.O., Doose S., Sauer M., Kneussel M., Strømgaard K. Gephyrin-Binding Peptides Visualize Post-Synaptic Sites and Modulate Neurotransmission, Nature Chemical Biology, 28. November 2016. DOI: 10.1038/nchembio.2246
Kontakt
Prof. Dr. Markus Sauer, Lehrstuhl für Biotechnologie und Biophysik, Universität Würzburg, T (0931) 31-88687, m.sauer@uni-wuerzburg.de
Prof. Dr. Hans Maric, Zentrum für Biopharmazeutika, Universität Kopenhagen, T (0157) 34390860, HansMichael.Maric@sund.ku.dk
Weitere Bilder